手机: +86 135 3815 8788 (中文服务)
英国电话: +44 790 120 0000 (中文/英文服务)


Are you ready for Brexit impacts? Do you have a Brexit contingency plan?
You may need either an EU/EC European authorized representative based in EU-27 countries or a UK Authorised Representative (so-called "UK Responsible Person") based in UK, or may need both EU & UK representatives, depending on different brexit scenarios.
Register/Notify your MD-Medical Devices & IVD-In Vitro Diagnostic Medical
Devices with MHRA in UK & other EEA (EU/EFTA) authorities by world-leading
consultancy- Wellkang team based in both UK (England) & EU-27 (Ireland).
Wellkang team can help you under all Brexit scenarios!
Click here to get FREE Guide Now! |
请点击下列任何一个相关标题从而获得更为详细的介绍:
欧盟涉及医疗器械的相关法律
产品指令(Directives)
欧盟有3个针对医疗器械的产品指令,这些指令在欧洲经济区EEA共30个成员国境内有效。这3个产品指令为:
管理机关
每一个EEA成员国的政府指定专门的主管机关CB-Competent Body 或CA-Competent Authority负责在其境内执行3个针对医疗器械的产品指令。绝大多数的主管机关具有官方性质或半官方性质。
共告机构(通告机构)
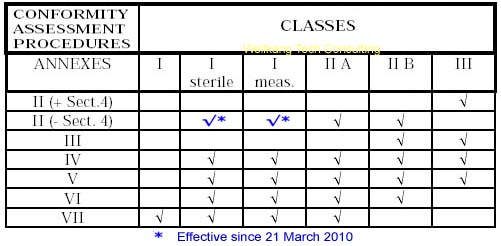
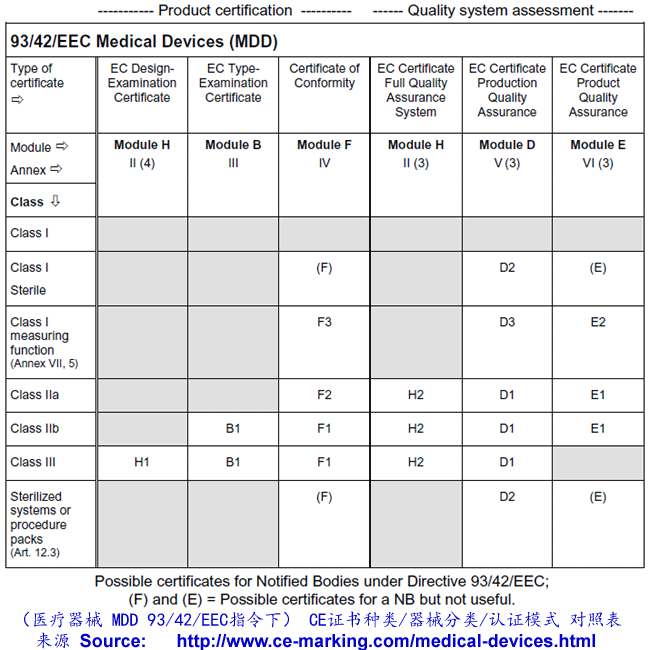
每一个EEA成员国的政府除了指定专门的主管机关外,还选择一定数量的第三方(多为非官方性质的)机构,通常称共告机构或通告机构(NB-Notified Body),负责针对制造商对产品指令的符合性进行评估和认证。这些共告机构由欧盟委员会统一编号。任何一个经过某家共告机构认证过的产品,在其CE标签的旁边必须印上该共告机构的(4位数)代号。
取决于其实力和能力,一个共告机构被授权的认证范围可能包括某个指令中所有允许的模式,或者只是其中部分或一个模式。因此,对于一个制造商来说,如何从众多的共告机构中选择一个合适的共告机构并采用最适合于自己的认证模式就显得格外重要!
其它相关的指令
下面的几个指令通常也会涉及到医疗器械:

我的产品属于医疗器械吗?
(普通)医疗器械MDD
这里的“医疗器械”包括的的范围比通常概念中的“医疗器械”广的多。
这里的“医疗器械”是指任何仪器、器械、器具、材料或其它物品(包括所必需的软件),
无论是单独使用还是联合使用,其制造商申明以人体作为使用对象其用途为以下之一:
- 疾病的诊断、预防、监视、治疗或减轻;
- 损伤或残障的诊断、监视、治疗、减轻或修补;
- 解剖学或生理学过程的研究,替换或改进;
- 妊娠的控制。
它们不是主要借助于药理学、免疫学或代谢作用等方式而达到其预定的目的,
但这些方式可以起到辅助作用。
体外诊断医疗器械 (IVD)
“体外诊断医疗器械”是指制造商预定用于体外检查从人体取得的样品,包括血液及组织供体的,无论单独使用或是组合使用的任何医疗器械,包括试剂、试剂产品、校准材料、控制材料、成套工具、仪表、装置、设备或系统,其唯一或主要目的是提供以下信息:
- 有关生理学或病理学状态;或
- 有关先天性异常;或
- 用于确定安全性以及与可能接受治疗者的相容性;或
- 用于检查治疗措施。
样品容器被认为是体外诊断医疗器械。“样品容器”是指,无论是或不是真空型的,其制造商明确规定主要用于盛装和保存从人体获得的样品作体外诊断检查的器械。
普通实验室用的产品不属于体外诊断医疗器械,除非此类产品根据其特性是制造商明确规定用于体外诊断检查用的;
主动可植入医疗器械 (AIMD)
任何经由手术或医疗方法,全部或部分植入人体,或插入并置留于人体自然孔道中之主动式医疗器械。

为什么必须将医疗器械, 体外诊断医疗器械(包括体外诊断试剂)信息注册/通告欧盟主管机关?
无论是欧盟的医疗器械指令(MDD 93/42/eec) 和体外诊断医疗器械指令(IVD 98/79/ec)都要求医疗器械制造商或其欧盟授权代表,向其注册的营业地点所在的欧洲经济区EEA成员国的主管机关(CA-Competent Authority),注册并提供某些资料和信息。这些要求已转变为所有欧洲经济区EEA成员国的本国法律。
所在EEA成员国的主管机关CA在收到医疗器械制造商或其欧盟授权代表的注册申请,并进行适当数据处理后,应当告知欧盟委员会。在要求的情况下,所在EEA成员国的主管机关CA应当告知其他EEA成员国的主管机关 (CAs-Competent Authorities)。
备注:
EEA成员国内的制造商可以自己直接向主管当局进行注册和通告。非EEA的(比如中国的)制造商在加贴CE标志时,就应该委托其欧盟代表到欧盟代表所在国的主管当局将制造商及产品信息完成注册(Registration)并取得注册号。

欧盟的主管机关收取注册费吗?
欧洲经济区EEA成员国的主管机关CA通常收取注册费,不同国家的主管机关收费方式和费用也不同。比如:
- 英国
主管机关按次数收费。 每次收取70英镑 (约合1050人民币RMB),不论产品数量。一年如果更新一次将收费70英镑,如果更新两次将收费140英镑。
- 西班亚
注册一个产品的起价为455.12Euro (约合4550人民币RMB)。
- 瑞典
主管机关按制造商及产品型号数量收取年费。 每一个制造商每年基本费2150克朗 (约合2365人民币RMB),另外
1至10个产品年注册费为1000克朗 (约合1100人民币RMB),超过10个产品按产品型号数量加收注册费。
一年之内不论更新/变更信息多少次,只要不增加产品型号数量,将不另外收费。

什么时候必须注册/通告主管机关?
- 对于(普通)医疗器械MDD:
所有的一类(Class I 包括灭菌类和计量类) 医疗器械制造商或其欧盟授权代表必须在第一次加贴CE标志时,就应该向其或其欧盟代表所在国的主管当局将制造商及产品信息完成注册并取得注册号。如果您有其它许多的产品型号即将在近期内加贴CE标志,您也可以一并提前向主管当局注册并取得注册号。
定制式 (custom-made) 医疗器械,系统或包装的制造商,以及灭菌消毒公司必须在不晚于首次申明其满足医疗器械指令(MDD 93/42/eec)要求时向主管当局注册并取得注册号。
备注:
中国的一类(Class I 包括灭菌类和计量类) 医疗器械制造商出口加贴CE标志的MDD前,要完成在欧盟境内注册,以免进入海关时出问题和引起法律纠纷,造成不必要的经济损失。
在EEA成员国内销售未经注册的一类MDD是违法的行为,销售未经欧盟注册而加贴CE标志的一类MDD到欧盟境外的第三国也是违法的行为。
-
对于体外诊断医疗器械IVDD:
所有的体外诊断医疗器械IVDDs (包括 List A, List B, Self-Testing, General/Other) 制造商或其欧盟授权代表必须在第一次加贴CE标志时,就应该向其或其欧盟代表所在国的主管当局将制造商及产品信息完成注册并取得注册号。如果您有其它许多的产品型号即将在近期内加贴CE标志,您也可以一并提前向主管当局注册并取得注册号。
备注: 中国的IVDD制造商在加贴CE标志时,就应该委托其欧盟代表到欧盟代表所在国的主管机关将制造商及产品信息完成注册(Registration)并取得注册号, 然后及时将已经注册的信息(包括CA名称及注册号)通告(Notify)所有其他(产品即将销往的)EEA成员国的主管机关。IVDD制造商出口加贴CE标志的IVDD前,要完成在欧盟境内注册,以免进入海关时出问题和引起法律纠纷,造成不必要的经济损失。
在EEA成员国内销售未经注册的IVDD是违法的行为,销售未经欧盟注册而加贴CE标志的IVDD到欧盟境外的第三国也是违法的行为。

已通告主管机关的信息变更了,怎么办?
不论何时,已经在欧洲经济区EEA成员国的主管机关注册的资料和信息(比如:名称,地址,联系电话/传真,产品信息,产品不再投放市场,等等)一有变更,医疗器械MDD 和体外诊断医疗器械IVDD 制造商或其欧盟授权代表,必须立即通知受理其注册的主管机关,并提供最新的消息并交纳相关的费用。
经过欧盟注册后,如果制造商名称变了,应该怎么办?
- 原有的技术文件中制造商名称全部要更换!
通常,技术文件可以无限次地更新(update)或修改(revise.) 但每次更新或修改后的版本(Version)必须注明。技术文件更新或修改后,总以新的版本为准。
- 制造商名称改变后,所有加贴CE标志的医疗器械的包装和标签上的制造商名称也必须更换成新名称。
- 如果制造商由公告机构签发CE证书的话,CE证书也必须以新的制造商名称重新签发。
- 欧盟法律要求欧盟授权代表处所保留的技术文件必须是最新版本,因此,制造商必须及时将最新版本的技术文件交到欧盟授权代表处。
- 如果制造商及其加贴CE标志的医疗器械已经在欧盟注册,注册证书也必须更换:如果使用新名称的制造商与老制造商属于同一个法人(Legal Entity),制造商的注册号仍然保持为原来的不变。如果使用新名称的制造商与老制造商属于不同的法人,制造商在欧盟的注册号也将改变。
更多关于制造商及其加贴CE标志的医疗器械在欧盟注册的问题,请参考系下面网页:
http://www.ce-marking.com/authorised-representative

体外诊断医疗器械(包括体外诊断试剂)IVD在欧盟注册与通告时应该注意的问题:
- 务必选择最合适的第一次注册(First Registration)的国家以及合适的主管机关(Competent Authority):
为了便于追踪和管理,非欧盟IVD制造商通常只能选择在一个EEA会员国的一个主管机关(CA)进行第一注册(registration of placing on the EEA market for the first time)。由该主管机关CA负责审核通过并将制造商及产品信息添加于欧盟的数据库,并配给制造商一个永久的注册号(类似于美国FDA的国外制造商的注册号)。然后,制造商才可以将已经注册过的信息:包括CA代码(Competent Authority Code), 名称(Competent Authority Name), 注册日期及注册号通告(Notify)所有其他(产品即将销往的)EEA成员国的主管机关。
一经注册后,体外诊断医疗器械制造商今后所有的数据更新及从EEA市场撤出,都必须经过进行第一注册的主管机关CA而进行。不同的成员国的注册主管机关CA的经验,能力,注册费用,需要材料,语言要求,也相差很大。因此,选择一个合适的第一注册国以及合适的主管机关非常重要!
- 让(非欧盟授权代表的)进口商代办第一次注册的后患:
在欧盟的IVD注册的数据库(European Databank)里,第6240栏目 “递交注册申请机构的状况” (status of the organization making this registration application) 里的选项只有下列两者之一:
- (EEA境内的) 制造商 Manufacturer (art. 10(1)); 或者
- (EEA境外制造商的) 欧盟授权代表 Authorized Representative (art. 10(3))。
因此,(非欧盟授权代表的)进口商是没有资格办理第一次IVD注册的! 某些不明法规的非专业的进口商有时将自己(Distributor) 错误地选为Authorized Representative (art. 10(3)), 从而进行了第一次IVD注册。这不仅会造成制造商违反IVDD指令的事实,而且会引起制造商和该进口商一系列的法律责任!
- 不同国家注册收费不同:
不同的成员国的注册主管机关CA的注册费用相差很大:比如英国收费70英镑(约合1050人民币RMB)起,瑞典至少3150克朗 (约合3465人民币RMB),而西班牙注册一个产品的起价为455.12欧元 (约合4550人民币RMB)。
- 不同国家语言要求不同:
- 注册申请材料的语言
为了尽可能地降低使用者的风险,欧盟不但要求医疗机械的技术文件必须以欧盟的官方语言撰写(注:中文版的技术文件无效), 而且通常的说明书,标签等必须有所投放市场当地的官方语言的版(译)本。多数国家在注册时要提供当地的官方语言的版本的说明书和标签等。
鉴于EEA目前有25种官方语言,
因此,选择用何种语言撰写医疗机械的技术文件,以及哪一个国家作为第一注册国就显得非常重要!例如:如果选择英国作为第一注册国,注册所需所有材料只要英语即可!
- 主管机关发证用的语言
通常,第一注册国主管机关CA签发的注册证或确认函均使用注册国的官方语言。虽然,某些非英语国家的个别主管机关注册内容部分有英文加注,但其核心内容如:产品名称,法律条款,职责,收费标准等,仍然以注册国的官方语言书写,这必将会给制造商和其它国家的经销商造成许多不必要的麻烦和困惑。
- 与主管机关来往信函所用的语言
第一注册国主管机关CA在审理注册材料过程中,以及今后的监督过程中(比如:警告信)与其境内的欧盟授权代表之间的所有往来信函,仅仅使用注册国的官方语言,比如,荷兰用荷兰语,德国用德语,瑞典用瑞典语,匈牙利用匈牙利语等等。大多数中国的制造商没有可能精通这些语言,而往往只能借助于非医疗器械专业的(非英语)翻译公司,这时候,如果其欧盟授权代表也不专业,制造商将可能承受极大的风险!
- 注册时涉及的法律条款所用的语言
欧盟的产品指令通常是通过转化成EEA成员国的本国法律而生效。成员国的本国法律只有其官方语言的版本才有法律效用。大多数EEA成员国的涉及医疗器械的本国法律连一个供参考用的由政府提供的英文版本都没有!因此,如果中国的制造商选择了一个非英语国家的欧盟授权代表和一个非英语国家作为第一注册国,就必须尽早聘请精通欧盟授权代表所在国语言和法律的律师为法律顾问,以备将来与其欧盟授权代表间产生纠纷时,或其投放欧盟市场的产品引起法律责任时,及时采取适当的行动。
如果中国的制造商选择了英国境内的欧盟授权代表(比如:英国伟康公司)和英国作为第一注册国,将来如果有需要的话,可以找到很多精通英国法律甚至可以在英国法庭出庭的香港律师。
- 不同国家要求注册材料也有差异:
不同的EEA成员国的注册主管机关对注册材料的要求也不完全相同。
- 比如,有的国家的主管机关要求:非欧盟制造商在给欧盟授权代表的授权书上的签名必须和签名人证件(身份证或护照)上的签名相同,同时必须提供签名人证件(身份证或护照)的复印件。因中文身份证不被接受,所以中国的制造商必须提供签名人护照的复印件。
- 也有的国家的主管机关要求:凡是由公告机构(Notified Body)签发CE证书的医疗器械,注册时,不但要提供本国语言版本的说明书和标签,而且本国语言版本的说明书和标签必须经过公告机构的书面确认,并提供书面确认函!
- 在英国最简单。
如果中国的制造商选择了英国境内的欧盟授权代表(比如:英国伟康公司)和英国作为第一注册国,不仅政府收费便宜,而且不需要中国的制造商提供签名人护照复印件。英语版本的说明书和标签即可,说明书和标签不需要经过公告机构的书面确认。

医疗器械产品出口到欧盟需要注册吗?
欧盟的法律要求,非欧盟的医疗器械制造商在加贴CE标志, 印刷标签和说明书时,必须印上制造商和制造商的欧盟代表的名称和地址。所有体外诊断医疗器械IVDD(包括试剂)以及所有I类医疗器械MDD, 在加贴CE标志时,就必须委托欧盟代表将制造商及产品信息在欧盟境内注册,进入欧盟数据库。出口前,要完成在欧盟境内注册,以免进入欧盟海关时出问题。
我公司要做Ⅰ类产品的CE认证, 符合性声明里要写产品型号, 很多Ⅰ类器械都没有型号, 是不是可以不写啊?
不可以不写!
为了保证产品的可跟踪性(traceability), 所有加贴CE的医疗器械都必须明确标上型号(或种类)及生产批号LOT。 另外,欧盟政府机构对违规产品的发出的“警告信” “召回信” 仅是针对特定的类别及产品型号而言,而并非针对所有的产品。有时候,如果制造商或其欧盟代表能提供足够的证据, 欧盟政府机构对违规产品发出的“警告信” “召回信” 可以限于仅是针对特定的类别及产品型号的特定生产批号LOT而言,而不必针对所有该型号的产品。
符合性声明 (DoC- Declaration of Conformity) 为所有Ⅰ类医疗器械产品加贴CE的主要法律依据,因此,DoC中不能省略类别及产品型号。
为什么I类的反而要欧盟代表拿去注册,而II, III类的就不要呢?
原因主要有二:
(1)
II, III类的产品已经有公告机构认证. 而I类为自我申明, 因此政府机构要注册审核.
(2)
II, III类的产品标签上已经有公告机构代码, 违规或出事故时政府机构可以直接找到公告机构调查/问责, 并联系制造商。I类产品只有通过注册后, 制造商信息才能进入欧盟数据库, 违规或出事故时政府机构才可以及时联系到制造商。

谁应该向主管机关申请/注册?
欧洲经济区EEA的主管机关通常对医疗器械的注册/通告收取一定费用。
- 对于一般医疗器械:
你必须向你所注册的营业地点所在的EEA成员国的主管机关 (Competent Authority) 进行注册,如果你(属于下列任一):
- 制造 I类 医疗器械或 定制式 (custom-made) 医疗器械,并以你自己的公司名义或商标将其投放于EEA市场;
- 完全翻新I类医疗器械,或为一个或多个现成的(I类)医疗器械加贴标签,以期把它们以你自己的公司名(或商标)投放于EEA市场;
- 将市场上现有的带有CE标志的医疗器械,在原制造商的预期使用目的和使用范围内,以你自己的公司名(或商标)置于一个系统或一个程序包之中;
- 为了能以你自己的公司名(或商标)投放于EEA市场,而对其他制造商制造的消毒后才可使用的系统或程序包或带有CE标志的医疗器械进行消毒处理;
- 是位于欧洲经济区EEA境外的医疗器械制造商的欧盟授权代表。
如果你是医疗器械制造商但是在欧洲经济区EEA境内没有注册的营业地址的话,你必须指定在欧洲经济区EEA的会员国内有注册营业地址的一个授权代表来履行你的职责。
定制式 (custom-made) 医疗器械是指根据一个专业的书写的处方而为某一个特定的病人专门使用非批量生产而制作的器械。
- 对于体外诊断医疗器械(IVD):
你必须向你所注册的营业地点所在的EEA成员国的主管机关 (Competent Authority) 进行注册,如果你(属于下列任一):
- 制造体外诊断医疗器械(IVD),并以你自己的公司名义或商标将其投放于EEA市场;
- 以你自己的公司名义或商标制造供性能评估用的体外诊断医疗器械(IVD);
- 是一个在欧洲经济区EEA境内没有注册营业地址的体外诊断医疗器械(IVD)制造商的欧盟授权代表。
如果你在欧洲经济区EEA境内没有注册的营业地址,而希望将体外诊断医疗器械(IVD)投放EEA市场的话,你必须指定在欧洲经济区EEA的会员国内有注册营业地址的一个授权代表来履行你的职责。

About CE Marking:
如果您需要更多关于CE认证的信息,欢迎访问我们的常见问题解答部分.
|